

专业的医学翻译服务
让您的沟通更简单
前言
近日,国家药监局发布关于批准注册180个医疗器械产品的公告,公告指出,2023年4月,国家药监局共批准注册医疗器械产品180个。其中,境内第三类医疗器械产品125个,进口第三类医疗器械产品21个,进口第二类医疗器械产品33个,港澳台医疗器械产品1个。
医疗器械是指用于预防、诊断、治疗、缓解人体疾病、损伤或残疾的器具、设备、器械、材料和其他类似物品。我国对医疗器械注册申请有严格的要求,需要申请人提交齐全、规范和完整的材料。接下来,小编为大家详细介绍医疗器械注册成功的秘诀有哪些。
01
做好准备工作
YIXUE YARACE
首先要充分了解医疗器械相关法规,确保在法规许可的范围内开展注册工作。目前构成我国医疗器械监管法规体系依次是国务院行政法规、部门规章和规范性文件。如:行政法规(法规条例)有《医疗器械监督管理条例》,在中华人民共和国境内从事医疗器械的研制、生产、经营、使用活动及其监督管理,均应当遵守本条例;

部门规章(办法、规定、规则)包括《医疗器械分类规则》、《医疗器械标准管理办法》、《医疗器械生产监督管理办法》等。
另外,企业还需对拟申请注册的产品进行研究,分析产品安全、有效基本原理,对影响安全性、有效性的因素进行分析,明确拟采用的技术评价方法,以及拟采取的控制措施。在充分准备的基础上,还需考虑企业内部人员配备情况、拟投入生产设施设备等因素。
02
确定产品分类
YIXUE YARACE
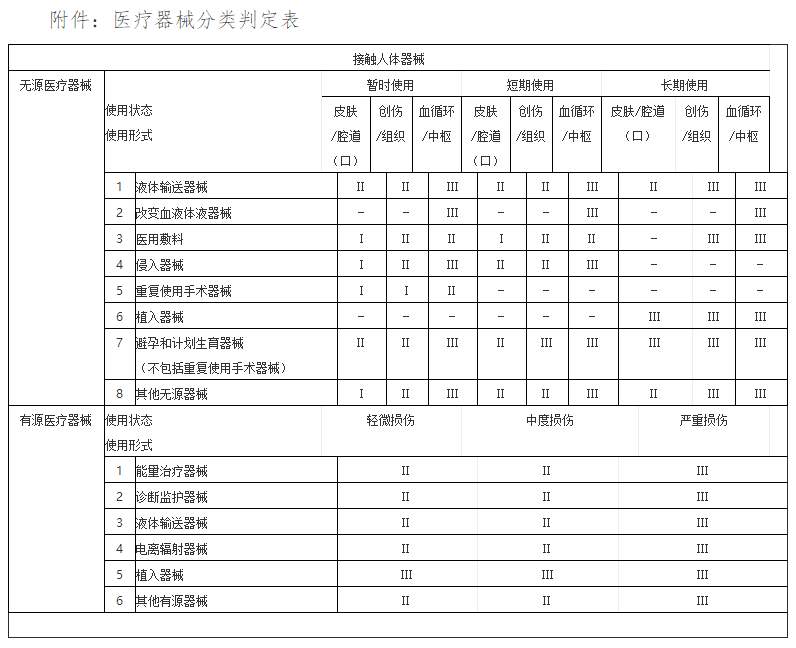
确定产品分类是注册的第一步,也是非常关键的一步。根据《医疗器械分类目录》,产品分类可分为第一类、第二类和第三类。对于产品类别划分不清的,申请人需要及时与技术审评机构沟通,明确产品类别。
一类医疗器械:风险程度低,实行常规管理可以保证其安全、有效的医疗器械。如:外科用手术器械(刀、剪、钳、镊、钩)、纱布绷带、引流袋等。
二类医疗器械:具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。如:医用缝合针、血压计、体温计、心电图机等。
三类医疗器械:具有较高风险、需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。如:植入式心脏起搏器、医用可吸收缝合线、血管内导管等。
根据结构特征的不同,分为无源医疗器械和有源医疗器械;根据是否接触人体,分为接触人体器械和非接触人体器械。
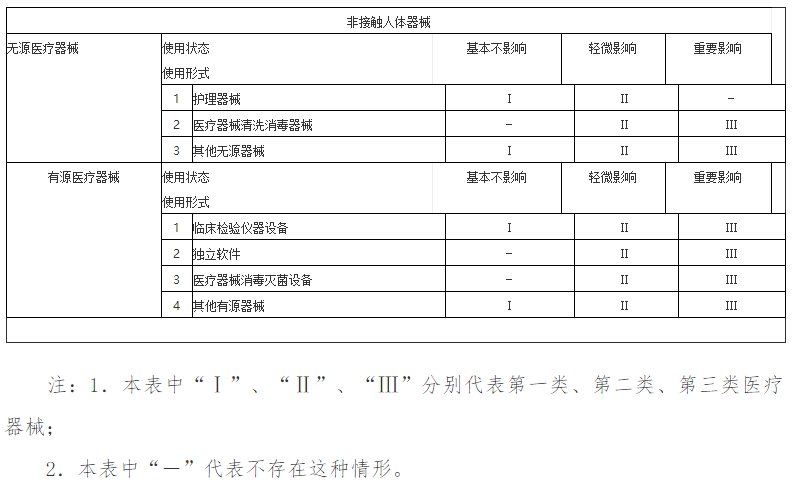
医疗器械产品类别划分与法规要求的关系密切,一般情况下申请人需要在申报资料中详细描述产品分类情况,这就需要申请人对其所申报的医疗器械产品类别进行认真分析和研究。
03
整理申报资料
YIXUE YARACE
“
1
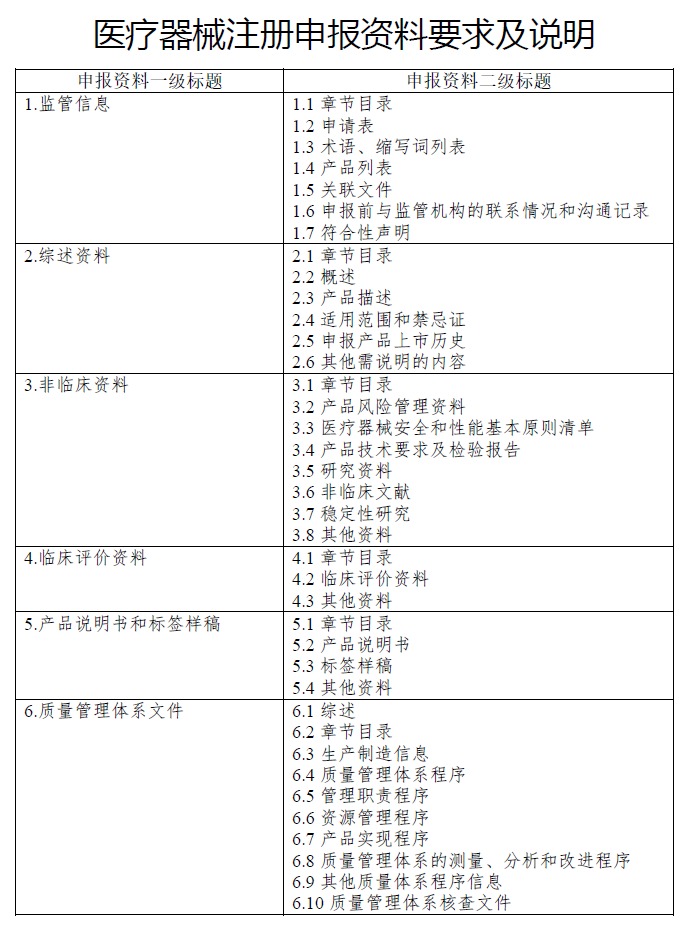
申报资料一般包括:医疗器械注册申请表、产品技术要求、说明书、标签及包装图、产品检验报告等内容,如果是第二类医疗器械,还应提供产品安全风险分析报告。上述资料均应提供原件,加盖生产企业公章。
“
2
申报资料中涉及检验报告的,应当提供相应的医疗器械检验机构出具的检验报告。
“
3
申报资料中涉及产品标准的,应当提供产品标准文本(包括外文文本),采用国家标准、行业标准作为产品的适用标准的,应当提交所采纳的国家标准、行业标准的文本;注册产品标准应当由生产企业签章。生产企业应当提供所申请产品符合国家标准、行业标准的声明,生产企业承担产品上市后的质量责任的声明以及有关产品型号、规格划分的说明,如为外文版本,需同时提供中文翻译件。
“
4
申报资料中涉及临床评价资料的,生产企业应当在两家以上(含两家)“医疗器械临床试验机构”进行临床试验,其临床试验资料中应当包括临床试验合同、临床试验方案、临床试验报告等。
04
规范翻译文件
YIXUE YARACE
由于医疗器械产品可能涉及到进口和出口问题,其注册信息也需要满足目标市场对医疗器械产品注册信息的要求,其中包括产品和文件的翻译和本地化。需要翻译资料包括但不局限于证明性文件、综述资料、临床评价资料、风险分析资料、产品技术资料等,以及产品使用说明书、产品操作、安装及维护手册、IEC报告、EMC报告、软件研究报告、eRPS文档编辑整理等。
医疗器械的翻译原则
专业忠实
医疗器械主要用于医学从业人员的工作中,其介绍指导性内容中每个词、每句话都传达着重要信息,其翻译不能出任何差错,一定要忠于原文。
通顺严谨
医疗器械的文本指导医学工作者正确使用设备,其操作过程十分复杂、严谨,每个环节之间都存在紧密联系,因此,必须做到文通理顺,逻辑严谨。
规范术语
医疗器械的术语并不局限于器械名称或手术名称这样的专用名称,还涉及到行业申报或国家发布的行业标准或指导原则中的内容,翻译时要勤查专业词典,保证准确性。
同时,译者还需要对产品进出口的目标国家的相关注册规定和标准有一个准确和清晰的认识,使翻译的文件在注册过程中顺利审批,并能够获得市场认证。
05
注册要点提示
YIXUE YARACE
1.注册医疗器械的过程具有系统性,企业必须对每一阶段的工作进行事先的整体计划。
医疗器械登记工作从申请材料的准备到核发许可证的过程都较为漫长,在注册过程中,企业、政府规章、产品都有可能会发生变化。此外,注册工作涉及到产品标准制定、注册检验、临床评价、系统评估、申报材料准备等一系列繁琐的工作,每一步都需要前后一致,所以在注册前要对注册工作进行规划。
2.医疗器械的注册需要多部门的合作和支持,企业的各个部门都应该对医疗器械的注册给予足够的重视。
医疗器械注册涉及到法规、标准、产品、系统、临床和市场等多方面的信息,需要多个部门协同工作,公司的其他部门在注册的过程中要给予充分的支持和配合。
3.注册证书是产品的身份证,注册备案文件为受控文件,因此注册资料需要认真准备和执行。
注册文件是今后生产企业应遵循的制度,也是上级部门监督的依据,注册文件不能与公司和产品的实际情况相冲突,同时,也要特别注重文件的翻译工作,否则对企业及产品的发展会有一定的影响。
4.在取得注册证后,还要对NMPA的相关信息进行跟踪和关注,做好重新注册、再注册的准备工作。
法规,标准,产品在获得注册证之后都可能会发生变化。企业应根据自己的产品市场变化的规律,制定相应的注册战略和工作方案,并对标准和法规的变动进行密切的跟踪,以确保及时做出反应。
医疗器械注册是一个复杂的过程,不仅要求企业医疗器械注册人员要具备一定的专业素质,还需要企业负责人、研发人员、质量管理体系人员等多方面的人员共同努力,才能确保产品安全有效。我国医疗器械行业有着巨大的发展潜力,企业应当特别注意医疗器械的注册流程、文件翻译、行业规范与监管,确保其安全性和服务质量,这样在医疗器械注册申请中也能更顺利的通过审批。


部分图片来源于网络,版权归原作者所有,如有侵权请联系删除
雅瑞思医学翻译
雅瑞思医学翻译一直专注于医药、医疗器械领域翻译,拥有上百名药学、医学、物理学、生物学、制造学、工程学专职翻译专家。笔译团队均由持有翻译资格证且从事翻译工作十年以上的资深翻译和审校组成,其中80%为硕士及以上学历。雅瑞思医学翻译目前已合作过上千家医药、医疗器械相关企业,翻译服务涵盖世界主流语言,日翻译量可达60万字。
官网:http://yixue.yarace.com/
电话:18942048531 / 0731-85160593
邮箱:info@yarace.com

信达雅,逐瑞境,思无界
KEEP WORKING, LEARNING AND THINKING