
eCTD是什么?
eCTD(electronic Common Technical Document,电子通用技术文档)是国际人用药品注册技术协调会(ICH)多学科系列的指导原则,编号M8。
eCTD的本质是基于XML主干网语言(可扩展标记语言)技术,并结合了MD5文档加密手段,采用专业的eCTD编辑软件,将CTD格式文件整合成符合法规要求且便于各国药监系统相关人员审阅、存储和便于全生命周期管理的电子申报格式。
CTD格式文件
XML主干网
MD5文档加密
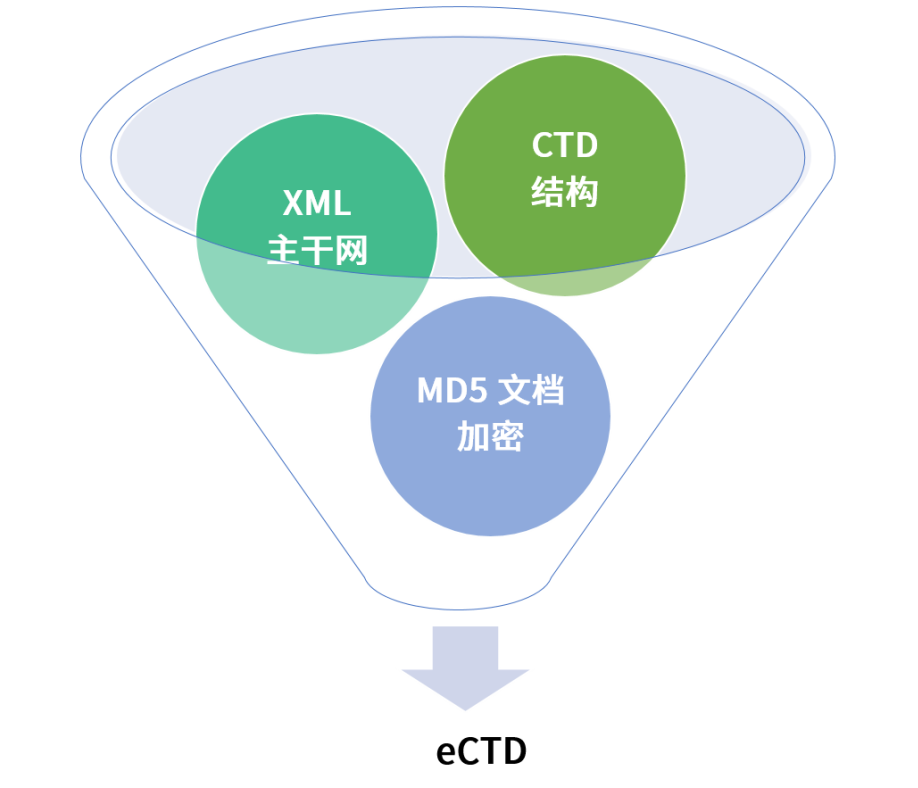
其中只有CTD格式文件需要申请人自己准备,其他都可通过编辑软件自动生成获得。

完整的eCTD体系结构不仅包括一套能够实现电子申报资料提交、接收、验证、受理、审评利用和电子存档的信息化系统,还包括一套既符合国际通用标准、又与区域法律法规有效衔接的技术指南体系。
eCTD的发展
eCTD的应用
美国:2017年5月5日起,NDA、ANDA都必须使用eCTD格式递交;2018年5月5日起,IND、DMF都必须使用eCTD格式递交。
欧盟:2018年起强制要求所有药品上市注册审评程序都以eCTD格式递交。
目前eCTD已被广泛应用于全球40多个国家和地区。
自2021年12月29日起,化学药品注册分类1类、5.1类,以及治疗用生物制品1类和预防用生物制品1类的上市许可申请,可按照eCTD进行申报。在eCTD实施初期,原纸质递交和电子递交并行。
2023年1月1日起,调整为以电子形式提交申报资料,标志着中国药品注册申报全面电子化。相信在接下来很长一段时间,中国会处于NeeS (Non-eCTD electronic Submissions)递交和eCTD递交并存的阶段。
eCTD电子递交流程
eCTD电子递交流程大体上可分为撰写(Authoring)、文档编辑(Dossier Publishing)、递交(Submitting)三个阶段。其中最为耗时和复杂的是文档编辑工作。

在文档编辑阶段,申请人需要准备好全套的CTD格式文件,将之转换为eCTD格式。CTD文件分为五个模块,内容涵盖质量、非临床和临床的文本、报告、图谱等,轻松累计数万页。药企在“走出去”和“引进来”时,常常需要委外翻译。
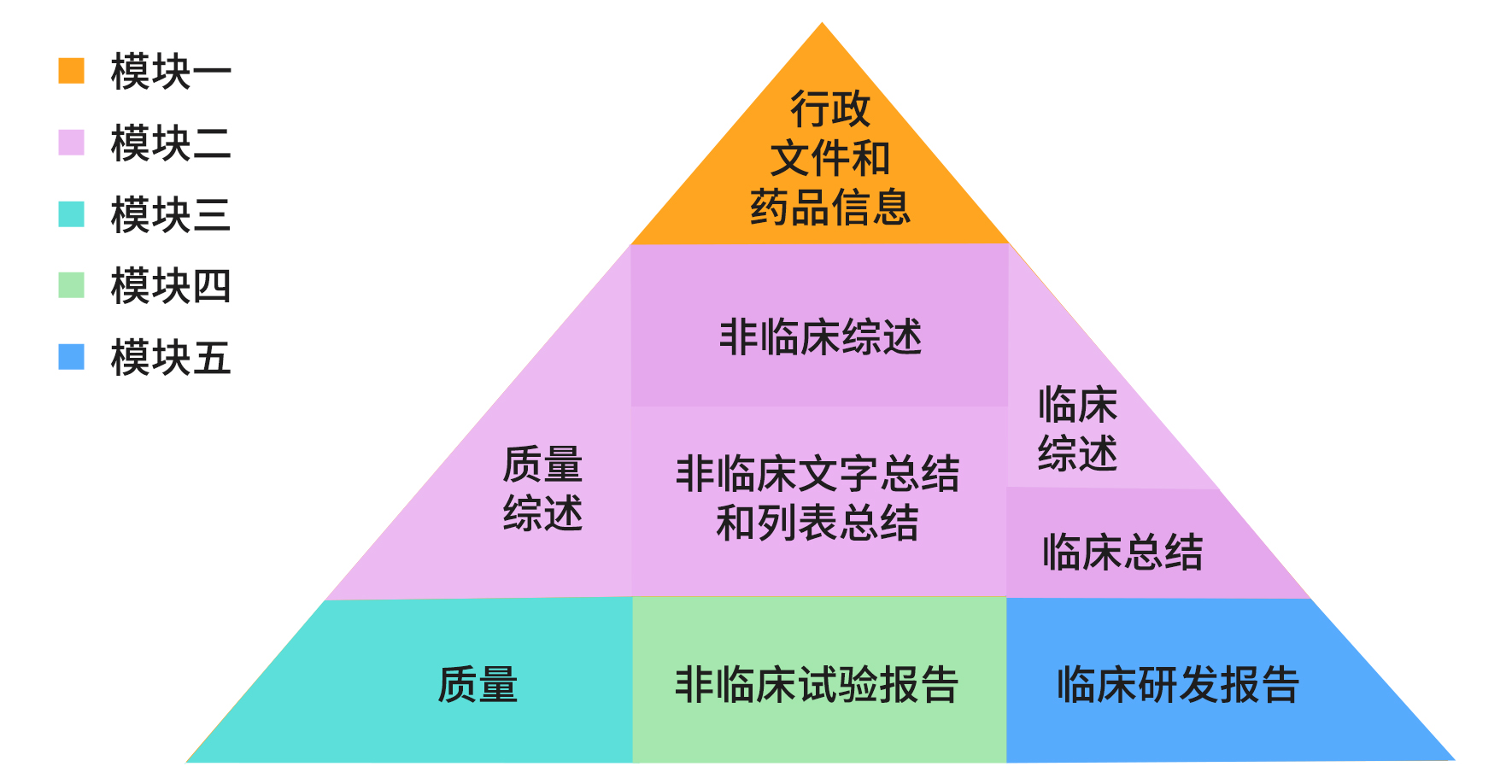
CTD模块金字塔结构
CTD模块1为行政文件和药品信息;模块2是对模块3(质量,药学部分)、模块4(非临床研究报告)、模块5(临床研究报告)方面内容的高度总结概况。其中模块1内容的差异会影响到后面4个模块的组织编排,因此在进行翻译的过程中,需要对现有的资料目录进行更加细致的整理,并对现有法规、指南等进行全面梳理。
在文档编辑过程中,PDF文件的处理转化涉及大量的书签、链接的创建,以及多文件PDF属性设置等,需要耗费大量的时间和人力来完成。
雅瑞思医学翻译团队对于药品注册文件的翻译有着丰富的项目经验,熟悉药品注册的法规政策和不同地区的申报要求,能够深入文档重新梳理内容、精准把握注册要点,协助企业完成文件的整理、格式转换和提交工作,保证项目的快速顺畅推进,加快新药开发进程。
eCTD的未来
当前国际通行的eCTD 指南是ICH 于2008 年7月发布的V3.2.2 版本,该版本较为成熟。
ICH 于2015 年发布了eCTD V4.0,相关指南和技术规范正在完善中,尚无任何国家或地区开始实施eCTD V4.0。
eCTD V4.0的目录和层级结构更加扁平,文件的组织、再利用及维护更加便捷,同时还可支持医疗器械、保健品等申报资料的电子化申报及审评,预计将是eCTD 的未来发展方向。
结语
eCTD 作为一种先进的、格式化的药品注册事务申请标准,给药品注册工作带来了巨大的促进和变革,已经被越来越多国家的药品监管部门所接受。
在全球医药市场竞争日益激烈的背景下,医药企业亟需提升市场的竞争力,助力药品更快更好的上市。雅瑞思将医药翻译与eCTD解决方案相结合,提供一站式高效服务,减轻客户管理压力,助力企业加快申报进度、轻松应对跨国注册挑战。

部分图片来源于网络,版权归原作者所有,如有侵权请联系删除
雅瑞思医学翻译一直专注于医药、医疗器械领域翻译,拥有上百名药学、医学、物理学、生物学、制造学、工程学专职翻译专家。笔译团队均由持有翻译资格证且从事翻译工作十年以上的资深翻译和审校组成,其中80%为硕士及以上学历。雅瑞思医学翻译目前已合作过上千家医药、医疗器械相关企业,翻译服务涵盖世界主流语言,日翻译量可达60万字。
官网:http://yixue.yarace.com
电话:18942048531 / 0731-85160593
邮箱:info@yarace.com


信达雅,逐瑞境,思无界
KEEP WORKING, LEARNING AND THINKING